Massnahmen des Bundes zur Senkung der Gesundheitskosten und zur Förderung von Generika und Biosimilars – für Sie zusammengefasst
Was bedeutet das für Sie?
- Rezeptpflichtige Arzneimittel (SL) unter einem Einkaufspreis/Fabrikabgabepreis (FAP) von 15 Franken werden im Publikumspreis teurer und Arzneimittel über einem Einkaufspreis/ Fabrikabgabepreis (FAP) von 15 Franken günstiger.
- Gleicher Vertriebsanteil für Originale/Generika und für Biologicals/Biosimilars
- Bei der Wahl von Generika und Biosimilars
- mit günstigerem Fabrikabgabepreis (FAP) -> geringere Kapitalbindung
- weniger administrativer Aufwand durch wegfallende Dokumentationspflicht
Die Details inkl. Berechnungsbeispiele
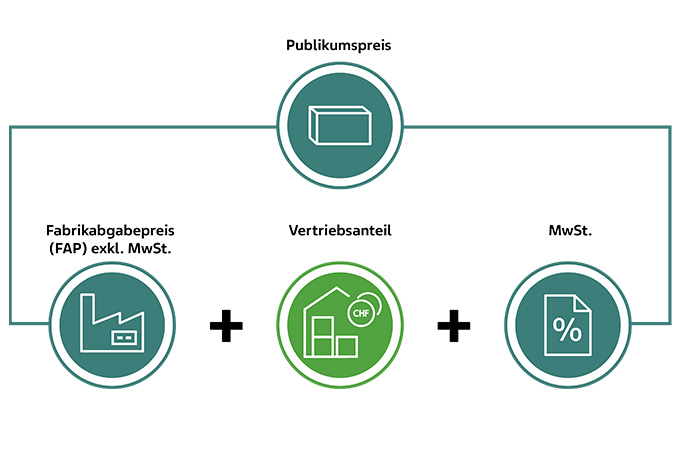
Per 1. Juli 2024 setzt das Bundesamt für Gesundheit (BAG) ein neues Berechnungsmodell für den Publikumspreis um. Dadurch ändern sich die Publikumspreise. Für die in der SL aufgelisteten Arzneimittel wird der Publikumspreis wie folgt berechnet:
Die Änderung des Publikumspreises basiert auf zwei Anpassungen beim Vertriebsanteil:
1) Das Berechnungsmodell für den Vertriebsanteil rezeptpflichtiger Arzneimittel wird angepasst
2) Ein einheitlicher Vertriebsanteil bei wirkstoffgleichen Arzneimitteln wird eingeführt
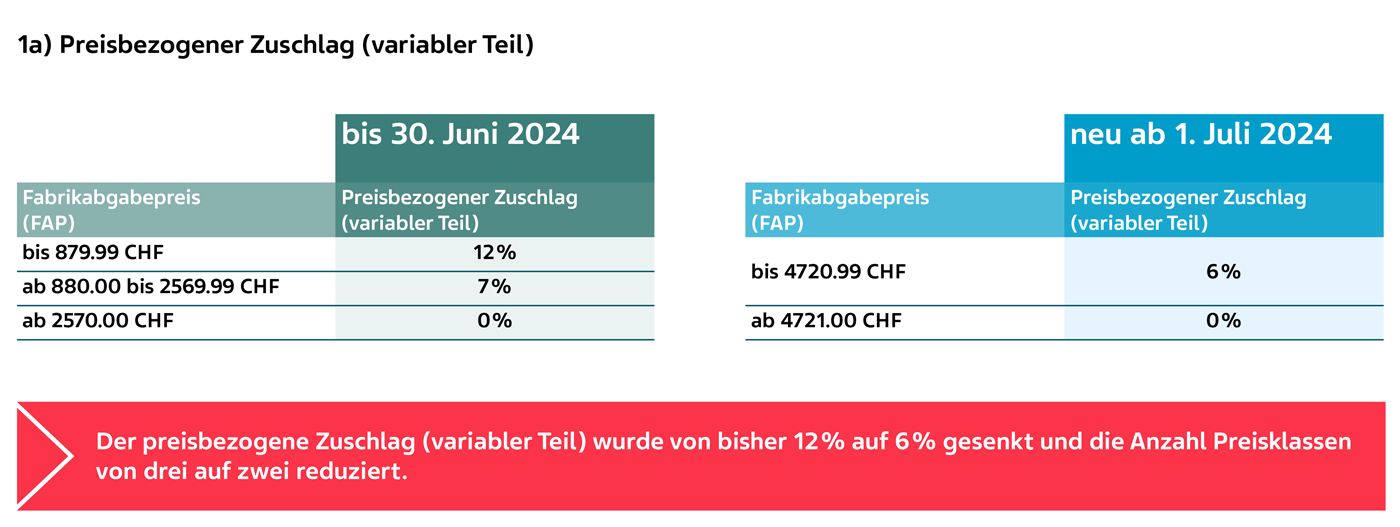
1) Berechnungsmodell für den Vertriebsanteil rezeptpflichtiger Arzneimittel (KLV Art. 38 Abs. 1 und 2)
Die Berechnung des Vertriebsanteils setzt sich aus einem preisbezogenen Zuschlag (variabler Teil) und einem Zuschlag pro Packung (fixer Teil) zusammen.

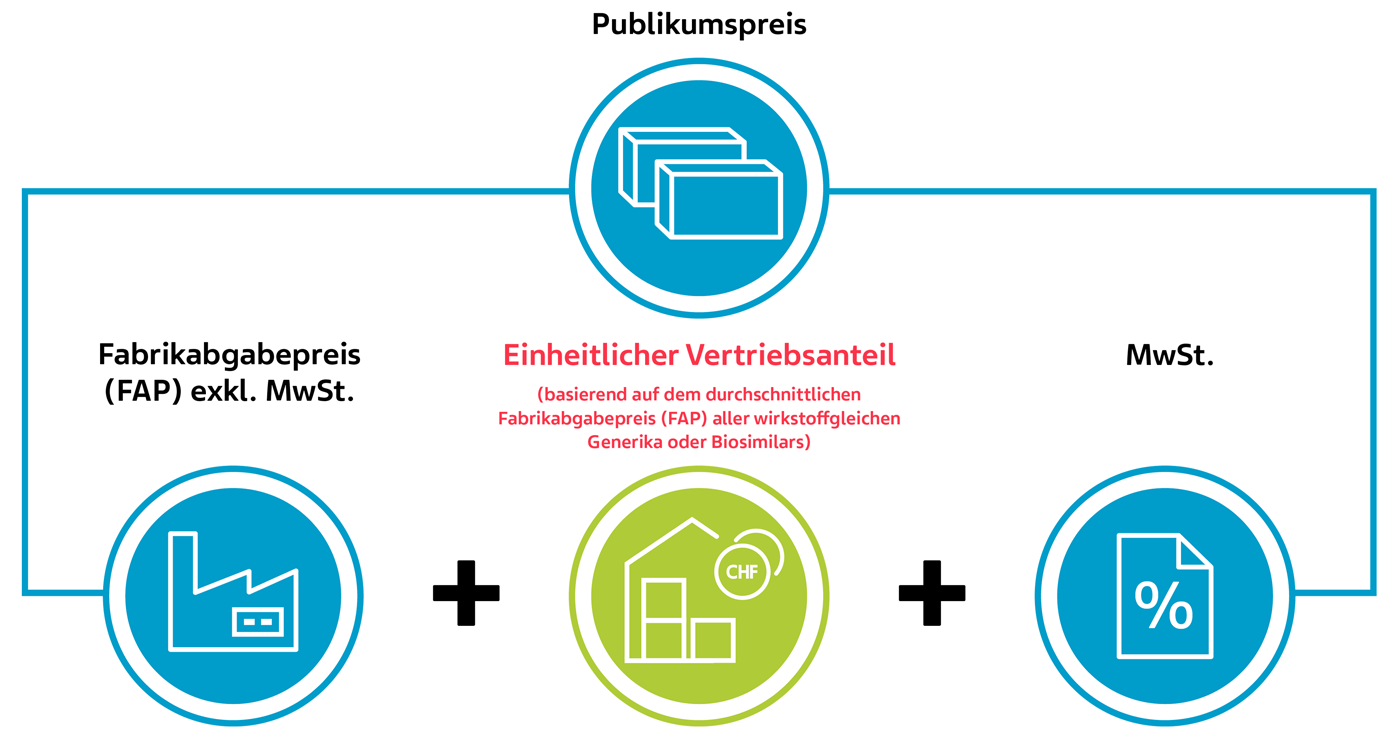
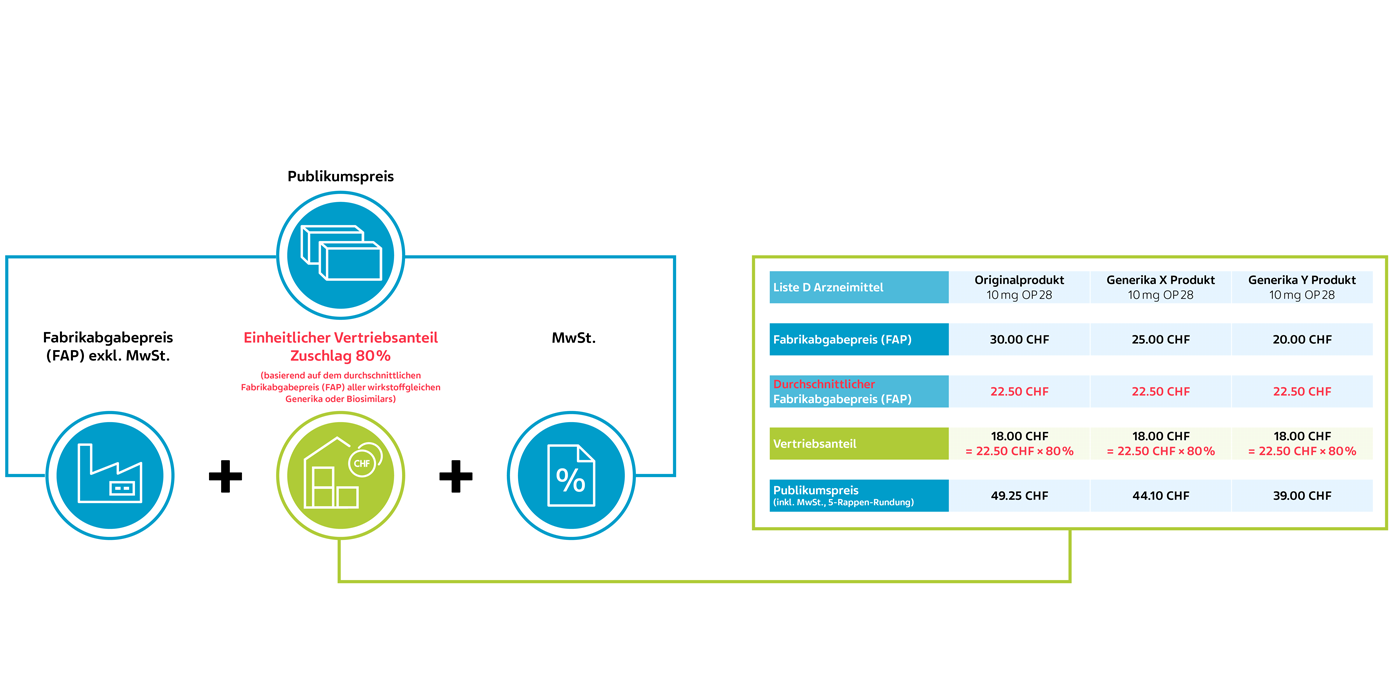
2) Einheitlicher Vertriebsanteil (KLV Art. 38 Abs. 4)
Neu wird der Vertriebsanteil für wirkstoffgleiche Arzneimittel basierend auf dem durchschnittlichen Fabrikabgabepreis (FAP) der Generika oder der Biosimilars festgelegt.
Neu ab 1. Juli 2024 – für wirkstoffgleiche Arzneimittel
(für SL-Arzneimittel der Liste A, B und D)
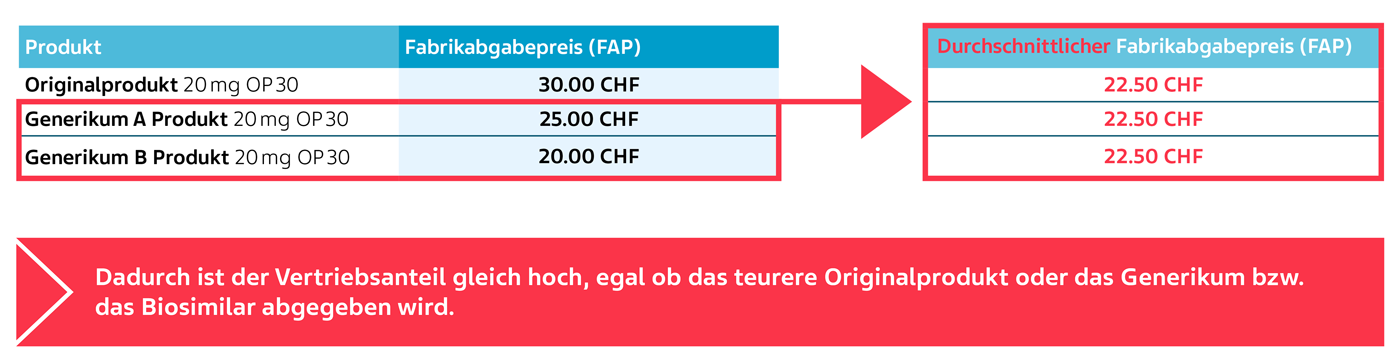
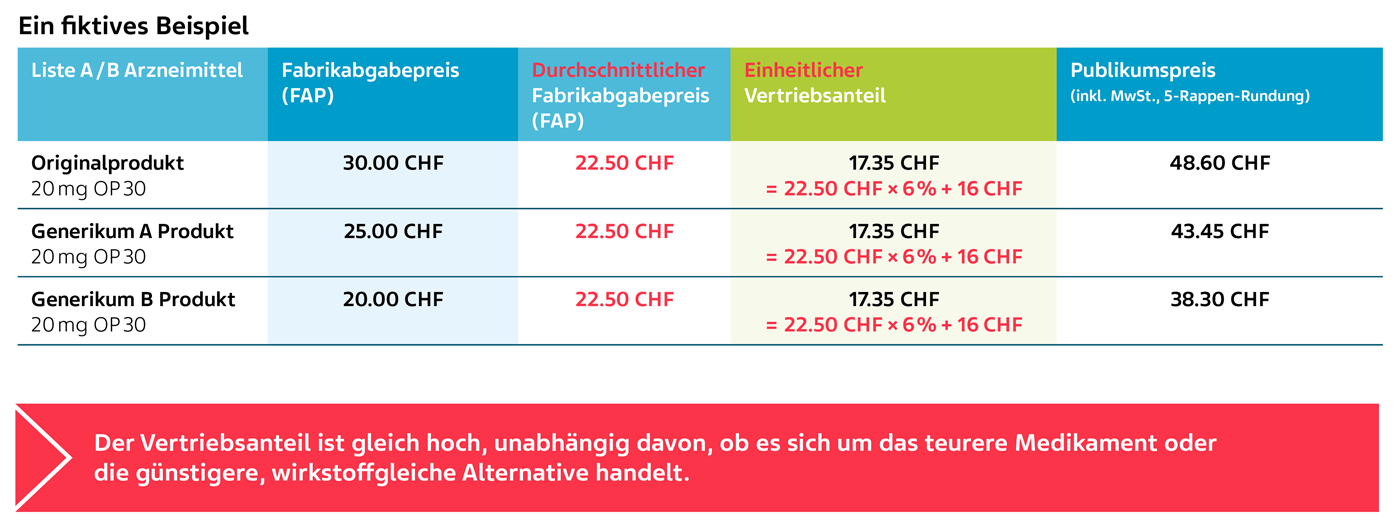
Die Berechnung des durchschnittlichen Fabrikabgabepreises (FAP) anhand eines fiktiven Beispiels:
Der durchschnittliche Fabrikabgabepreis (FAP) von Generika A und B beträgt CHF 22.50 und gilt als Ausgangswert für die Berechnung des Vertriebsanteils für alle wirkstoffgleichen SL-Arzneimittel.
Berechnungsbeispiele
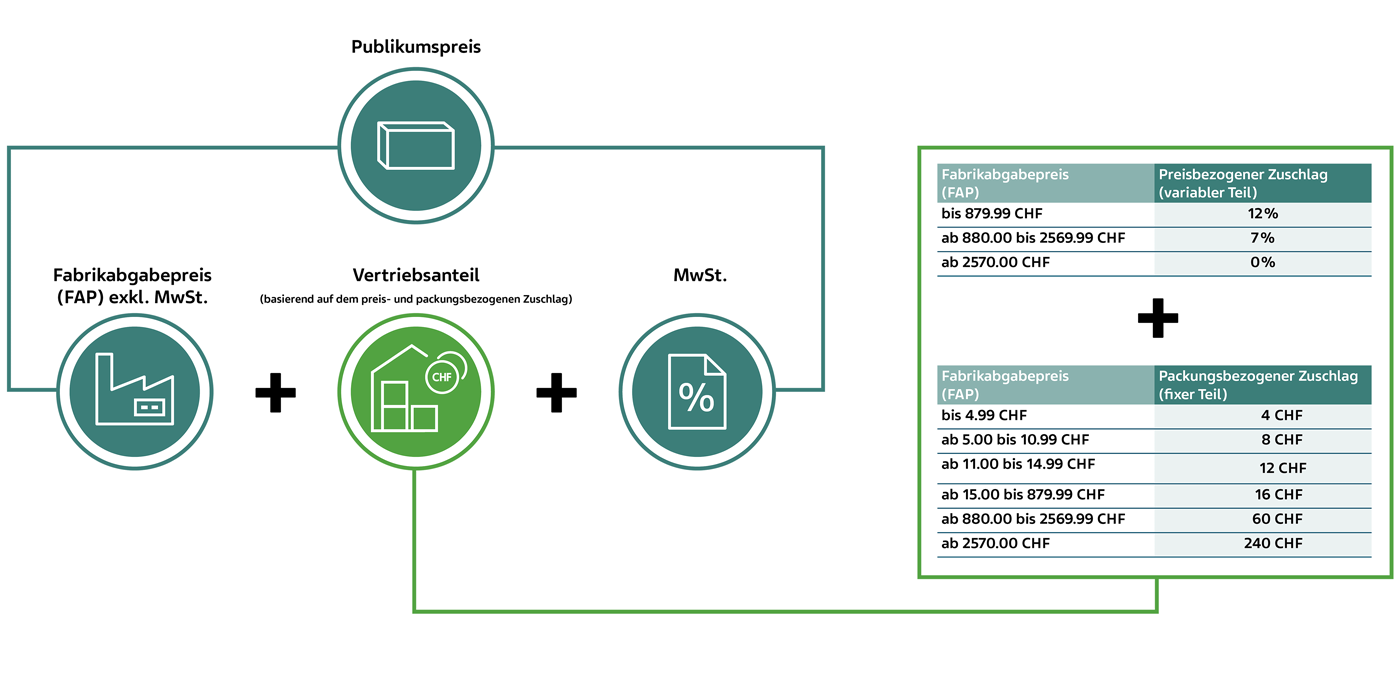
Bis 30. Juni 2024 – für Arzneimittel der Liste A/B
Berechnung des Publikumspreises der SL-Arzneimittel Liste A/B bis 30. Juni 2024 anhand eines fiktiven Beispiels (KLV Art. 38 Abs. 1 und 2):

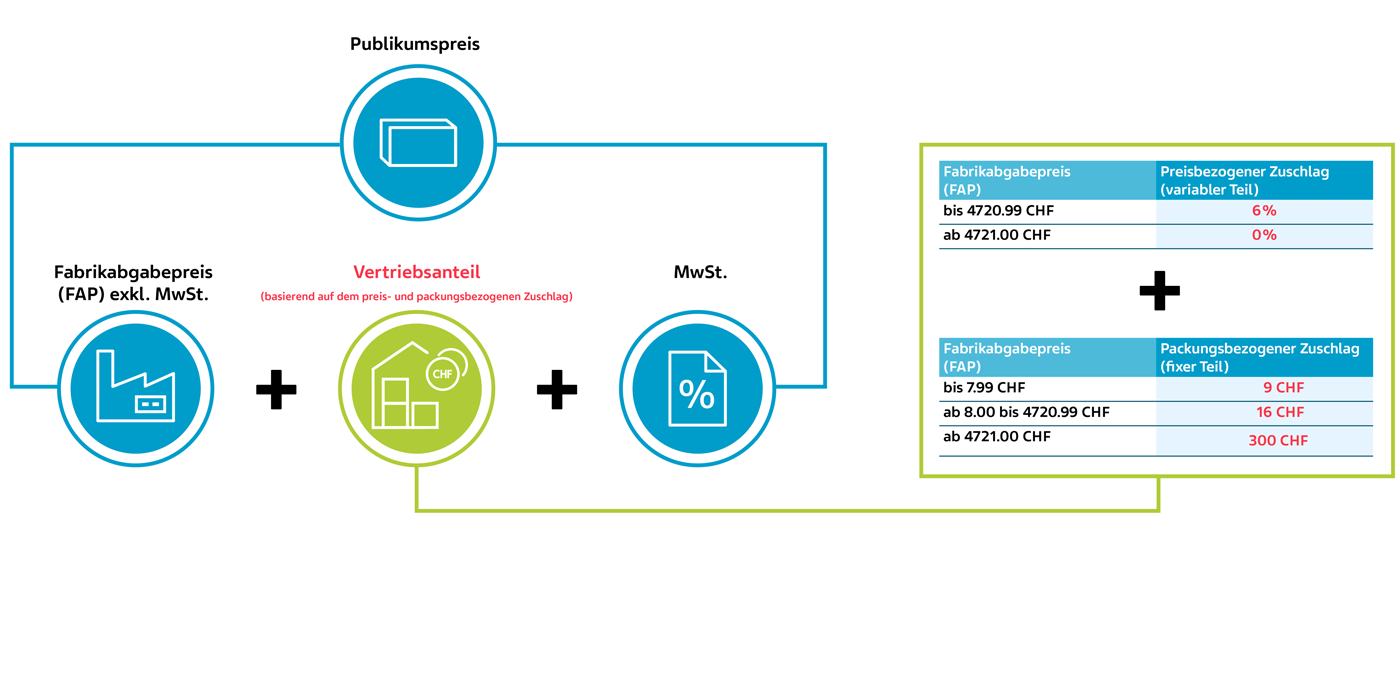
Neu ab 1. Juli 2024 – für Arzneimittel der Liste A/B
Berechnung des Publikumspreises neu ab 1. Juli 2024 anhand eines fiktiven Beispiels (KLV Art. 38 Abs. 1 und 2)

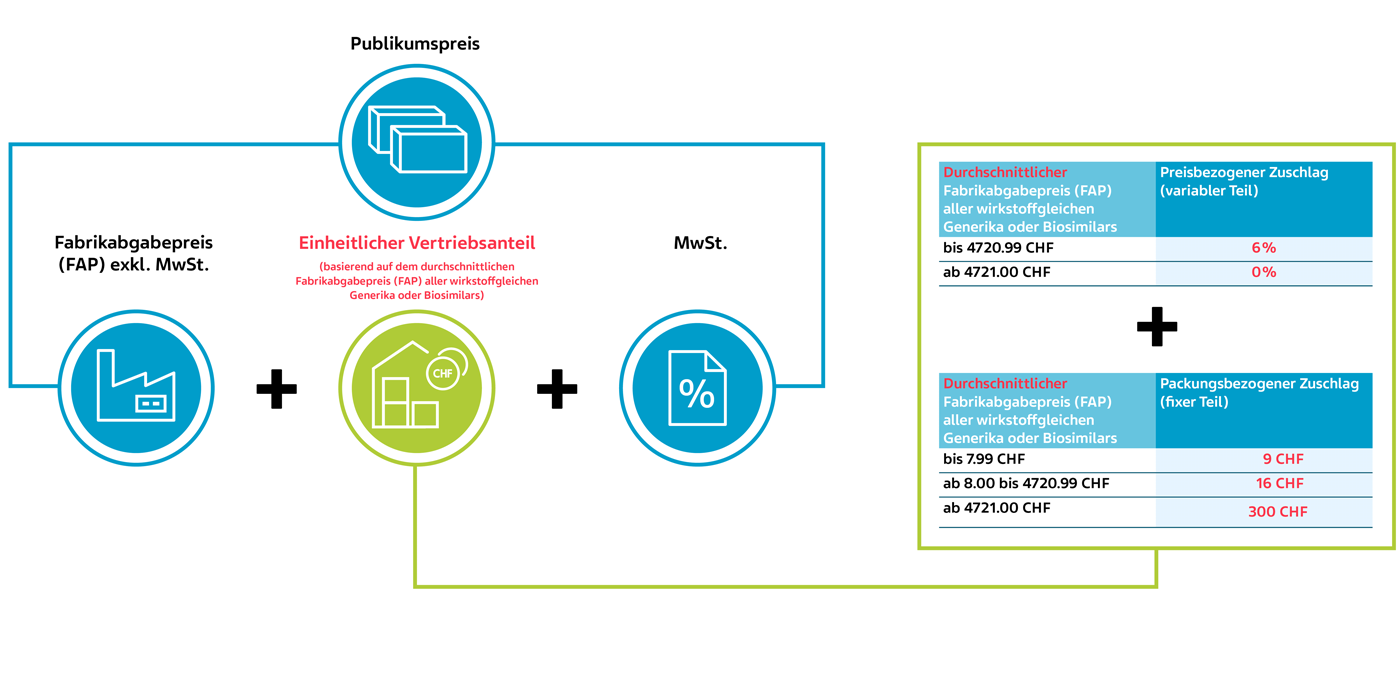
Neu ab 1. Juli 2024 – für wirkstoffgleiche Arzneimittel der Liste A/B
Berechnung des Publikumspreises für wirkstoffgleiche Arzneimittel der Liste A/B neu ab 1. Juli 2024 anhand eines fiktiven Beispiels (KLV Art. 38 Abs. 1 und 2)
Für Liste D SL-Präparate bleibt die Vertriebsanteilsberechnung gleich, sofern kein günstigeres, wirkstoffgleiches Arzneimittel gelistet ist.
Berechnung des Publikumspreises für SL-Arzneimittel der Liste D (KLV Art. 38 Abs. 1 und 2):
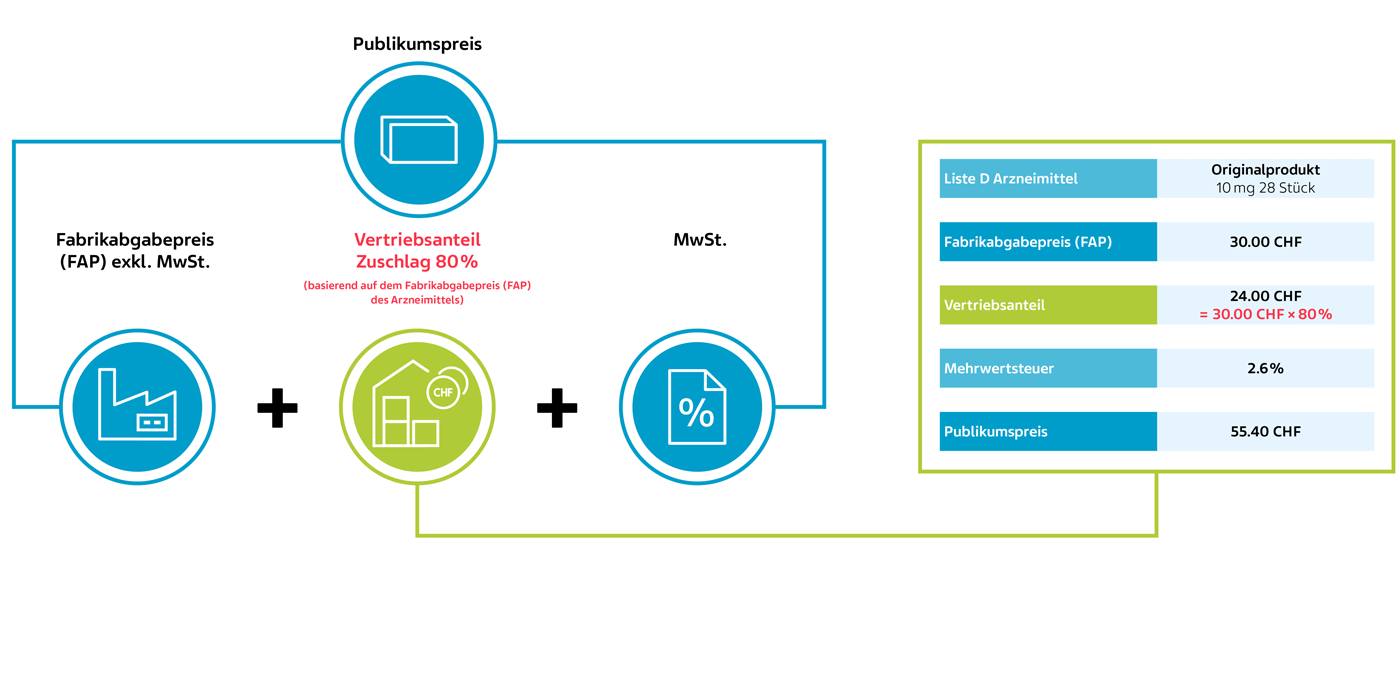
Neu ab 1. Juli 2024 – für wirkstoffgleiche Arzneimittel der Liste D
Berechnung des Publikumspreises für wirkstoffgleiche Arzneimittel der Liste D neu ab 1. Juli 2024 anhand eines fiktiven Beispiels (KLV Art. 38 Abs. 1 und 2):
Bereits per 1. Januar 2024 wurden Massnahmen des Bundes zur Senkung der Gesundheitskosten und zur Förderung von Generika und Biosimilars in Kraft getreten. Diese Änderungen betreffen Arzneimittel der Spezialitätenliste. Die wichtigsten Änderungen aus diesen Rechtsgrundlagen1 sind folgende:
Erhöhter Selbstbehalt (Art. 38a KLV und Art. 140a Abs. 2 KVV)
- Der erhöhte Selbstbehalt hat sich von 20% auf 40% verdoppelt. Diese Regelung gilt neu auch für biotechnologisch hergestellte Arzneimittel.
- Produkte mit einem erhöhten Selbstbehalt sind auf der Spezialitätenliste (www.spezialitätenliste.ch) in der Spalte SB mit einem rot markierten Kreuz gekennzeichnet.
Vergleich erhöhter Selbstbehalt anhand eines Beispiels:

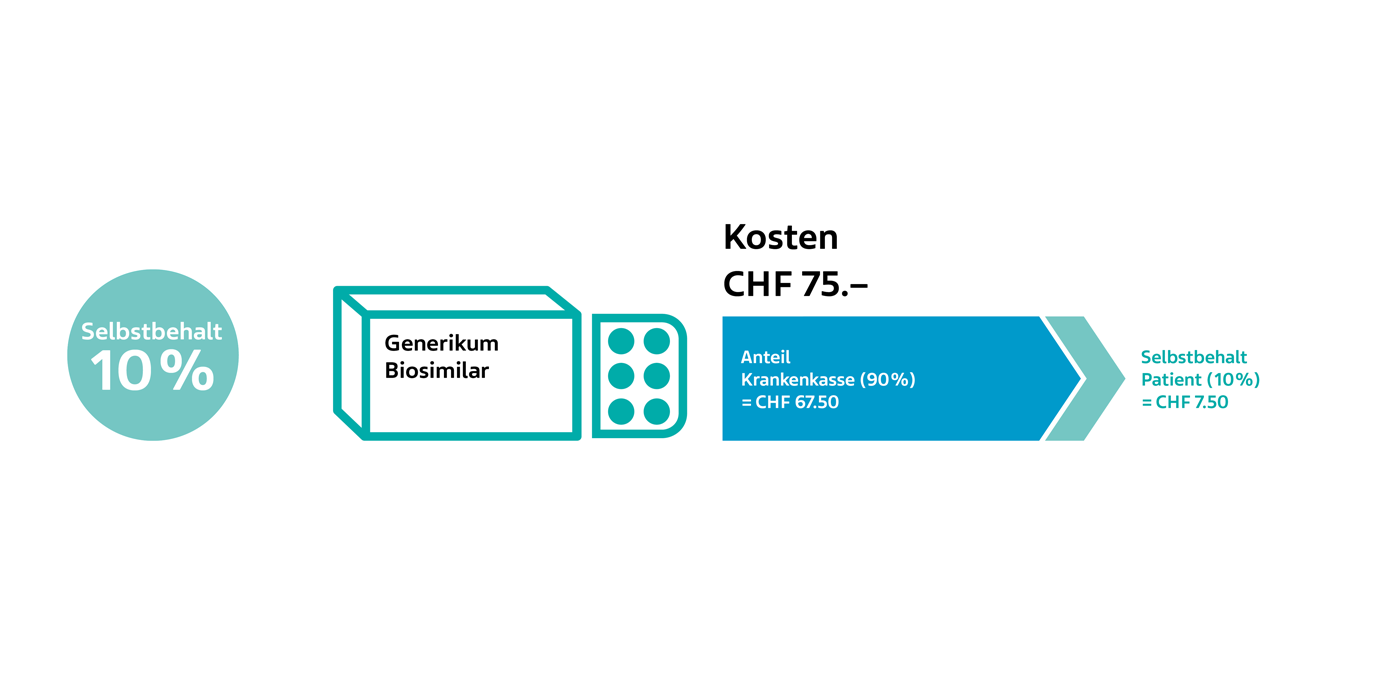
- Bei Produkten mit erhöhtem Selbstbehalt werden nicht 40% sondern nur 25% an den Selbstbehalt von CHF 700.– angerechnet.
- Bei Produkten mit 10% Selbstbehalt werden die vollen 10% an die CHF 700.– angerechnet.
Durch die Wahl von Generika oder Biosimilars spart Ihr Patient doppelt: durch den tieferen Medikamentenpreis und den tiefen Selbstbehalt. |
*Die Originalprodukte und Biologicals mit erhöhtem Selbstbehalt sind nach IT-Kapitel abzurufen unter www.spezialitätenliste.ch/ShowNewGenerics.aspx
Substitution biotechnologisch hergestellter Arzneimittel (Art. 52a KVG)
- Fachpersonen können auch biotechnologisch hergestellte Arzneimittel (Biologicals) mit günstigeren Alternativen (Biosimilars) ersetzen.
Informationspflicht an Patienten (Art. 38a Abs. 8 KLV)
- Fachpersonen müssen über günstigere wirkstoffgleiche Alternativen informieren, sowie wenn das Arzneimittel einen höheren Selbstbehalt hat.
Dokumentationspflicht2
Wie bisher kann noch immer aus medizinischen Gründen oder bei Lieferproblemen ein teureres Arzneimittel verordnet oder abgegeben werden, ohne dass der erhöhte Selbstbehalt anfällt. Als medizinische Begründung gilt zum Beispiel Unverträglichkeit oder ungenügende Wirksamkeit nach einem Therapieversuch mit mindestens zwei Generika resp. Biosimilars. Die Begründung ist zu dokumentieren:
- Auf Rezept
- «aus medizinischen Gründen nicht substituieren»
- «aufgrund Lieferengpass nicht substituierbar»
Wichtig: Der Vermerk SIC ist nicht mehr gültig.
- Im System und Abrechnung:
- Substitution abgelehnt durch Patienten
- Substitution abgelehnt durch Arzt
- Substitution abgelehnt durch Apotheke
Für die Ablehnung muss der genaue Grund dokumentiert werden. Beispiel: Die Nichtlieferbarkeit des günstigeren Präparates muss mit einem Printscreen des Bestellfensters des üblichen Grossisten dokumentiert werden.2
Durch proaktives Verschreiben oder Abgeben von Generika und Biosimilars entfällt der administrative Aufwand der Dokumentationspflicht. |
1Detaillierte Informationen können Sie auf der BAG-Website entnehmen: www.bag.admin.ch/bag/de/home/gesetze-und-bewilligungen/gesetzgebung/gesetzgebung-versicherungen/gesetzgebung-krankenversicherung/kvg.html
